Həllolma. Məhlullar
Həllolma. Məhlullar
Bir və ya bir neçə maddə hissəciklərinin başqa maddə hissəcikləri arasında yayılması prosesinə hallolma deyilir. Bir və ya bir neçə maddənin digər maddədə paylanmasından alınan qarışıqlar dispers sistemlər adlanır. Hissəcikləri yayılan maddəni həllolan maddə (dispers faza), onların yayıldığı mühiti isə həlledici (dispers mühit) adlandırırlar.
Həllolma təkcə fiziki proses olmayıb, həm də kimyəvi prosesdir. Yəni maddələrin bir-birində həllolması zamanı, sadəcə, bir maddənin xırdalanaraq başqasının içərisində yayılması (diffuziyası) getmir, bu fiziki proseslə yanaşı, həllolan maddənin hissəcikləri ilə həlledici hissəcikləri arasında kimyəvi qarşılıqlı təsir baş verir. Bəzi maddələrin (H2SO4, NaOH və s.) suda həll olması zamanı istiliyin ayrılması da bunu sübut edir.Həllolan maddələrlə həlledicidən ibarət olan bircinsli sistemə məhlul deyilir.
Məhlul maye, qaz və bərk halda ola bilər. Məsələn, çaylar, göllər və dənizlər — maye, azot, oksigen və başqa qazlardan ibarət olan hava — qaz, metalların bir-birində həll olmasından alınan çuqun və polad isə — bərk məhlullardır.
Praktikada sulu məhlullardan — maddələrin suda həll olmasından alınan məhlullardan daha çox istifadə olunduğundan burada onlardan bəhs ediləcəkdir.
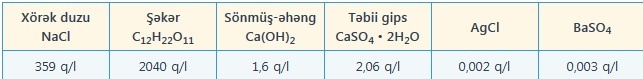
Maddələrin suda həllolma qabiliyyəti müxtəlif olur. Eyni miqdar suda eyni şəraitdə bəzi maddələr çox, bəziləri az, bəziləri lap az həll olurlar. Məsələn, şəkər, xörək duzu, əhəng, təbii gips, gümüş(I)xlorid (AgCl) və barium-sulfatın (BaSO4) otaq temperaturunda (20°C-də) 1000 q (və ya 1000 ml) suda həllolma qabiliyyətini (q/l) müqayisə edək.
Məhlulun müəyyən həcmində otaq temperaturunda həll olan maddənin miqdan az olduqda ona duru məhlul, çox olduqda isə qatı məhlul deyilir. Məsələn, 1 stəkan (170 q) suda 1—2 qənd parçasının (10—20 q) həll edilməsindən alınan məhlula duru, 4—5 qənd parçasının (40—50 q) və ondan çox miqdarda həll edilməsindən alınan məhlula qatı məhlul demək olar.
Həll olan maddənin miqdarını bildirən doymuş və doymamış məhlul anlayışı da işlənir.
Müəyyən temperaturda həll olan maddənin daha həll ola bilmədiyi məhlula doymuş məhlul deyilir.
Müəyyən temperaturda həll olan maddənin əlavə miqdarının həll ola bildiyi məhlul isə doymamış məhlul adlanır.
Doymuş məhlulu qızdırmaqla tədricən həll olan maddə əlavə edib, sonra alınan məhlulu başlanğıc məhluldakı temperaturadək soyutduqda ifrat doymuş məhlul alınar.
İfrat doymuş məhlullarda həll olan maddənin miqdarı doymuş məhluldakından çox olur. Lakin ifrat doymuş məhlullar çox davamsız olur. Xarici təsirdən dərhal dağılaraq doymuş məhlula çevrilir.
Əgər bir stəkan suda otaq temperaturunda (20°C-də) 1, 2 və ya 3 qənd parçası həll edilirsə və daha bir neçəsini də həll etmək mümkün olursa, deməli, bu məhlul doymamış məhluldur. Qənd parçalarının sayını artırmaqla onları qarışdırıb, həll etməni davam etdiririk. Nəhayət, qarışdırmaqla da stəkandakı məhlulun dibində həll olmayan şəkər qalırsa, alınan məhlul doymuş məhlul adlanır.
«Doymuş məhlul»la «qatı məhlul» anlayışlarını bir-birilə qarışdırmaq olmaz. Az həll olan maddələrin çox az miqdarının olduğu duru məhlula da doymuş məhlul demək olar.
Suda az həll olan maddələrin (çöküntülərin) doymuş məhlulu duru, suda yaxşı həll olan maddələrin doymuş məhlulu isə qatı məhlul adlanır.
Su ilə reaksiyaya girib, yeni birləşmə əmələ gətirən maddələrin və çöküntülərin məhlulunu hazırlamaq mümkün deyil. Lakin suda yaxşı həll olan maddələrin məhlulunu hazırlamaq mümkündür.
Həllolma əmsalı. Maddələrin həllolma qabiliyyətini həllolma əmsalı ilə ifadə edirlər.
Müəyyən temperaturda 1000 ml (1 l) həlledicidə maddənin həll ola bilən qramlarla miqdarına həllolma əmsalı deyilir.
Həllolma əmsalı Kh ilə işarə edilir, onun vahidi q/l-dir. Əgər 11 suda otaq temperaturunda (20°C-də) 359 q xörək duzu, 1,6 q sönmüş əhəng, 2 • 10-3 q gümüş(I)xlorid həll olursa, onda yazırıq:
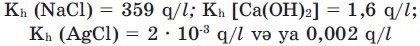
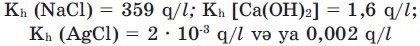
Həllolma əmsalını doymuş məhlulda aşağıdakı düsturla hesablamaq olar: p (H2О)= 1 q/ml olduğundan msu=Vsu
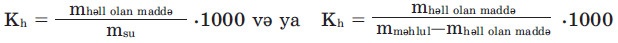
Məsələn, 20°C-də 1000 ml suda ən çox 2040 q şəkər həll olur. Bu o deməkdir ki, 20°C-də şəkərin həllolma əmsalı 2040 q/l-dir.
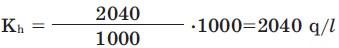
Maddələrin həllolma əmsalı temperaturdan asılı olaraq dəyişir. Temperatur yüksəldikcə əksər bərk maddələrin suda həllolma əmsalı da artır, qazların həll olması isə əksinə, azalır. Qazların suda həll olması təzyiqlə düz mütənasibdir. Yüksək təzyiqdə qazlar suda daha çox həll olur. Bunu təzyiq altında çoxlu karbon qazı həll edilmiş mineral su butulkalarının ağzı açıldıqda dərhal müşahidə edirik. Bu halda böyük təzyiqdə artıq miqdarda həll edilmiş qaz məhluldan ayrılıb çıxır.
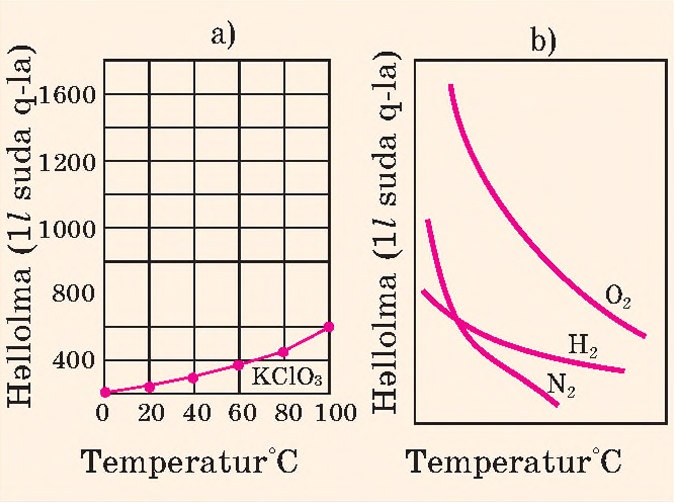
Əksər duzların suda həll olması endotermik proses olduğundan temperatur artdıqca duzların həll olması artır. Qazların (və qələvilərin) suda həll olması, adətən, ekzotermik proses olduğundan temperatur artdıqca onların həllolması azalır. Duzların və maye halındakı maddələrin həll olmasına təzyiq təsir etmir. Həllolmanın temperaturdan asılılığı həllolma əyriləri ilə göstərilir
Həllolma əyrilərinin köməyi ilə müxtəlif temperaturlarda maddələrin həllolma əmsallarını təyin etmək mümkündür. Bərk və maye maddələri suda həll etdikdə sistemin həcmi nəzərə çarpacaq dərəcədə dəyişmir. Lakin qazların suda həll olması sistemin həcminin azalması ilə baş verir. Ona görə də təzyiqin artırılması qazların həll olmasını artırır.
Bəzi maddələri (benzin, kerosin, bitki yağı, gil, təbaşir tozu) su ilə qarışdırdıqda, yuxarıda qeyd olunduğu kimi, adi (və ya həqiqi) məhlul deyil, asılqanlar adlanan qarışıq alınır.
Həllolma əyrilərinin köməyi ilə müxtəlif temperaturlarda maddələrin həllolma əmsallarını təyin etmək mümkündür. Bərk və maye maddələri suda həll etdikdə sistemin həcmi nəzərə çarpacaq dərəcədə dəyişmir. Lakin qazların suda həll olması sistemin həcminin azalması ilə baş verir. Ona görə də təzyiqin artırılması qazların həll olmasını artırır.
Bəzi maddələri (benzin, kerosin, bitki yağı, gil, təbaşir tozu) su ilə qarışdırdıqda, yuxarıda qeyd olunduğu kimi, adi (və ya həqiqi) məhlul deyil, asılqanlar adlanan qarışıq alınır.
Asılqanlarda su içərisində yayılan maddə hissəcikləri adi gözlə də seçilir, çünki onların ölçüsü (100 nm-dən) böyükdür. Həqiqi məhlullarda isə həll olan maddənin hissəcikləri molekullardan və ya ionlardan ibarət olduğu üçün mikroskopla da görünmür (ölçüsü 1 nm-dən kiçikdir).
Asılqanlar iki növdür: suspenziyalar və emulsiyalar. Bərk maddə hissəciklərinin suda bərabər paylandığı asılqanlara suspenziya deyilir. Gilin, əhəngin, təbaşirin su ilə qarışığı suspenziya əmələ gətirir.
Maye hissəciklərinin suda bərabər paylandığı asılqanlar emulsiya adlanır. Yağların, benzinin, neftin su ilə qarışığı emulsiyalara misal ola bilər.
Həll olan maddənin hissəciklərinin ölçüsü 1—100 nm arasında olan sistemlərə kolloid məhlullar deyilir. Kolloid məhlullara yapışqanı, nişastanın qaynar suda məhlulunu göstərmək olar.
Asılqanlar iki növdür: suspenziyalar və emulsiyalar. Bərk maddə hissəciklərinin suda bərabər paylandığı asılqanlara suspenziya deyilir. Gilin, əhəngin, təbaşirin su ilə qarışığı suspenziya əmələ gətirir.
Maye hissəciklərinin suda bərabər paylandığı asılqanlar emulsiya adlanır. Yağların, benzinin, neftin su ilə qarışığı emulsiyalara misal ola bilər.
Həll olan maddənin hissəciklərinin ölçüsü 1—100 nm arasında olan sistemlərə kolloid məhlullar deyilir. Kolloid məhlullara yapışqanı, nişastanın qaynar suda məhlulunu göstərmək olar.
Müəllif: Nasim Abışov,Günay Quliyeva,Vəli Əliyev,Vaqif Abbasov,Mütəllim Abbasov
Mənbə: Ümumtəhsil məktəblərinin 7-ci sinfi üçün Kimya fənni üzrə Dərslik
