Maddə miqdarı, Molyar kütlə
Maddə miqdarı, Molyar kütlə
Dövri sistem cədvəlində hidrogenin nisbi atom kütləsinin Ar(H) = 1,0078, oksigenin nisbi atom kütləsinin Ar(O) = 15,9994 olduğunu tapa bilərik. Bu kütlələri müqayisə etdikdə bir oksigen atomunun bir hid- rogen atomundan təqribən 16 dəfə ağır olduğu məlum olur. Əgər biz 1,0078 q hidrogen və 15,9994 q oksigen atomları götürsək, aydındır ki, hər iki nümunədə olan atomların sayı (N) eyni olacaqdır.
Bəs hər iki elementin götürdüyümüz kütlə miqdarında atomlarının sayı nə qədər ola bilər? Bunu təyin etmək üçün götürdüyümüz nümunələrin kütləsini bir atomun kütləsinə bölmək lazımdır:

Başqa elementlərin əmələ gətirdiyi bəsit maddələr üçün də oxşar hesablamalar aparsaq, hər dəfə eyni ədədin — 6,02•10 23 alındığını görərik. Yəni Ar© ≈ 12, Ar(S) ≈ 32, Ar(N) ≈ 14-dürsə, onda deyə bilərik: 12 q karbonda, 32 q kükürddə, 14 q azotda da 6,02•1023 sayda atomlar olmalıdır.
6,02•1023 ədədi məşhur italyan alimi Amedeo Avoqadronun şərəfinə Avoqadro ədədi (NA) adlandırılmışdır. Bu çox böyük ədəddən praktik hesablamalarda istifadə etmək əlverişli deyil. Ona görə də Avoqadro ədədi qədər hissəciyin sayını ifadə etmək üçün mol adlanan vahid qəbul edilmişdir.
Karbon izotopunun (12C) 12 q-dakı atomların sayı qədər hissəciyi (atom, molekul, ion və s.) olan maddə miqdarı mol adlanır.
Buradan belə nəticə də çıxarmaq olar: hər hansı biratomlu bəsit maddənin 1 molunda Avoqadro ədədi (6,02•1023), yəni NA qədər atom, yaxud istənilən mürəkkəb maddənin 1 molunda, yəni NA => Avoqadro ədədi miqdarında molekul olur.
12 q karbon — (12C) izotopunda 6,02•1023 sayda atom olduğunu artıq bilirik. Deməli, 1 mol karbonda 6,02•1023 sayda atom vardır. Eynilə deyə bilərik ki, hər hansı ikiatomlu bəsit maddənin 1 molunda Avoqadro ədədinin iki misli qədər (2.6,02•1023) atom olmalıdır.
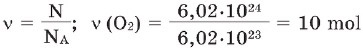
Mürəkkəb maddənin verilmiş mol miqdarında hər hansı elementin atomlarının sayı soruşulursa, onda maddənin mol miqdarını soruşulan elementin indeksinə, alınan hasili isə Avoqadro ədədinə vurmaq lazımdır. N(atom)= v (maddə) • İndeks • NA. Əgər atomların ümumi sayı soruşulursa, maddənin mol miqdarı elementlərin indeksləri cəminə, alınan hasil isə Avoqadro ədədinə vurulmalıdır.
N(atom) ümumi = v (maddə) • (indekslər cəmi) • NA
1 ədədi indeksdə yazılmır, əgər indeks yoxdursa, onu 1 götürmək lazımdır.
Məsələ 3. 0,5 mol suda neçə oksigen atomu vardır?
N(H20) = 0,5•6,02•1023=3,01•1023 molekul. N(0)= N(H20)
Suyun bir molekulunda 1 oksigen atomu olduğundan 0,5 molundakı oksigen atomlarının sayı su molekullarının sayına bərabər olacaqdır.
Məsələ 4. 0,5 mol H2SO3-dəki atomların ümumi sayını müəyyən edin.
N(atom) ümumi = v • (indekslərin cəmi) • NA=0,5 • (2+1+3) • 6,02•1023 = 3.6,02•1023 = 18,06•1023 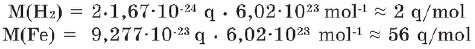
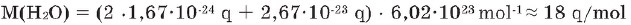
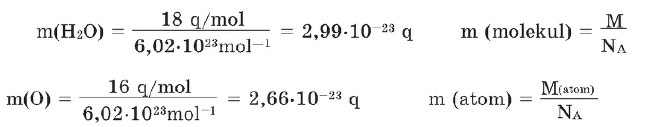
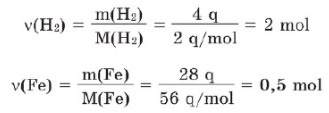
2. Maddənin kütləsi ilə onu təşkil edən hissəciklərin sayı arasındakı əlaqəyə aid hesablamalar:
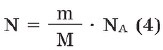
Bəs hər iki elementin götürdüyümüz kütlə miqdarında atomlarının sayı nə qədər ola bilər? Bunu təyin etmək üçün götürdüyümüz nümunələrin kütləsini bir atomun kütləsinə bölmək lazımdır:

Başqa elementlərin əmələ gətirdiyi bəsit maddələr üçün də oxşar hesablamalar aparsaq, hər dəfə eyni ədədin — 6,02•10 23 alındığını görərik. Yəni Ar© ≈ 12, Ar(S) ≈ 32, Ar(N) ≈ 14-dürsə, onda deyə bilərik: 12 q karbonda, 32 q kükürddə, 14 q azotda da 6,02•1023 sayda atomlar olmalıdır.
6,02•1023 ədədi məşhur italyan alimi Amedeo Avoqadronun şərəfinə Avoqadro ədədi (NA) adlandırılmışdır. Bu çox böyük ədəddən praktik hesablamalarda istifadə etmək əlverişli deyil. Ona görə də Avoqadro ədədi qədər hissəciyin sayını ifadə etmək üçün mol adlanan vahid qəbul edilmişdir.
Karbon izotopunun (12C) 12 q-dakı atomların sayı qədər hissəciyi (atom, molekul, ion və s.) olan maddə miqdarı mol adlanır.
Buradan belə nəticə də çıxarmaq olar: hər hansı biratomlu bəsit maddənin 1 molunda Avoqadro ədədi (6,02•1023), yəni NA qədər atom, yaxud istənilən mürəkkəb maddənin 1 molunda, yəni NA => Avoqadro ədədi miqdarında molekul olur.
12 q karbon — (12C) izotopunda 6,02•1023 sayda atom olduğunu artıq bilirik. Deməli, 1 mol karbonda 6,02•1023 sayda atom vardır. Eynilə deyə bilərik ki, hər hansı ikiatomlu bəsit maddənin 1 molunda Avoqadro ədədinin iki misli qədər (2.6,02•1023) atom olmalıdır.
Mol anlayışını molekul və ionlardan təşkil olunmuş maddələrə də tətbiq etmək olar. Məsələn, 1 mol hidrogen qazında 6,02•1023 molekul, 1 mol xörək duzunda (NACl) 6,02•1023 natrium ionu (NA+) və bir o qədər də (6,02•1023) xlor ionu (Cl-) vardır. Maddələrin 1 molunda olan hissəciklərin sayı (6,02•1023) Avoqadro sabiti (NA) adlanır: NA= 6,020•1023 mol-1.
AMEDEO AVOQADRO (1776-1856)
İtalyan alimi, 1811-ci ildə qazlar haqqında qanun kəşf etmiş, sonralar bu qanun onun adı ilə adlandırılmışdır.
İtalyan alimi, 1811-ci ildə qazlar haqqında qanun kəşf etmiş, sonralar bu qanun onun adı ilə adlandırılmışdır.
Avoqadro sabitinin Avoqadro ədədindən fərqi onun müəyyən vahidlə (mol-1) ölçülməsidir.
Aydındır ki, maddə miqdarı (onu v hərfi ilə işarə edək) dəyişdikdə hissəciyin sayı da dəyişəcəkdir. Bu asılılığı aşağıdakı düsturla ifadə etmək olar: N = v • NA
Bu düstur əsasında müxtəlif hesablamalar aparmaq olar:
Məsələ 1. 2 mol və 0,1 mol sudakı molekulların sayı nə qədərdir?
N(H20) = 2.6,02•1023 = 12,04•1023 molekul
N(H20) = 0,1.6,02•1023 = 0,602•1023 və ya 602•1020 molekul.
Məsələ 2. Molekulların sayı 6,02•1024 olan oksigenin maddə miqdarı (v) nə qədərdir?
Aydındır ki, maddə miqdarı (onu v hərfi ilə işarə edək) dəyişdikdə hissəciyin sayı da dəyişəcəkdir. Bu asılılığı aşağıdakı düsturla ifadə etmək olar: N = v • NA
Bu düstur əsasında müxtəlif hesablamalar aparmaq olar:
Məsələ 1. 2 mol və 0,1 mol sudakı molekulların sayı nə qədərdir?
N(H20) = 2.6,02•1023 = 12,04•1023 molekul
N(H20) = 0,1.6,02•1023 = 0,602•1023 və ya 602•1020 molekul.
Məsələ 2. Molekulların sayı 6,02•1024 olan oksigenin maddə miqdarı (v) nə qədərdir?
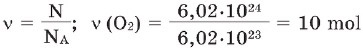
Mürəkkəb maddənin verilmiş mol miqdarında hər hansı elementin atomlarının sayı soruşulursa, onda maddənin mol miqdarını soruşulan elementin indeksinə, alınan hasili isə Avoqadro ədədinə vurmaq lazımdır. N(atom)= v (maddə) • İndeks • NA. Əgər atomların ümumi sayı soruşulursa, maddənin mol miqdarı elementlərin indeksləri cəminə, alınan hasil isə Avoqadro ədədinə vurulmalıdır.
N(atom) ümumi = v (maddə) • (indekslər cəmi) • NA
1 ədədi indeksdə yazılmır, əgər indeks yoxdursa, onu 1 götürmək lazımdır.
Məsələ 3. 0,5 mol suda neçə oksigen atomu vardır?
N(H20) = 0,5•6,02•1023=3,01•1023 molekul. N(0)= N(H20)
Suyun bir molekulunda 1 oksigen atomu olduğundan 0,5 molundakı oksigen atomlarının sayı su molekullarının sayına bərabər olacaqdır.
Məsələ 4. 0,5 mol H2SO3-dəki atomların ümumi sayını müəyyən edin.
N(atom) ümumi = v • (indekslərin cəmi) • NA=0,5 • (2+1+3) • 6,02•1023 = 3.6,02•1023 = 18,06•1023
Molyar kütlə. Maddənin 1 molunun qramla ifadə olunmuş kütləsinə molyar kütlə deyilir (vahidi q/mol olur).
Hər hansı maddənin molyar kütləsini (M) hesablamaq üçün Avoqadro sabitini maddəni təşkil edən hissəciklərin (atom, molekül, ion) qramla ifadə olunmuş kütləsinə vurmaq lazımdır:
Hər hansı maddənin molyar kütləsini (M) hesablamaq üçün Avoqadro sabitini maddəni təşkil edən hissəciklərin (atom, molekül, ion) qramla ifadə olunmuş kütləsinə vurmaq lazımdır:
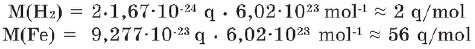
Beynəlxalq vahidlər sistemində molyar kütlənin vahidi kq/mol ilə ölçülsə də, məktəb kursunda, əsasən, q/mol vahidindən istifadə edilir.
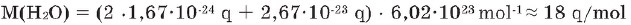
Hesablamalar göstərir ki, maddənin molyar kütləsi qramlarla ifadə olunduqda, ədədi qiymətcə onun nisbi atom kütləsinə (əgər o atomlardan təşkil olunursa) və ya nisbi molekul kütləsinə (əgər molekullardan təşkil olunursa) bərabərdir. Müqayisə üçün yazaq:
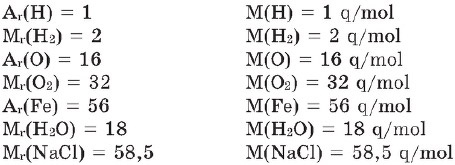
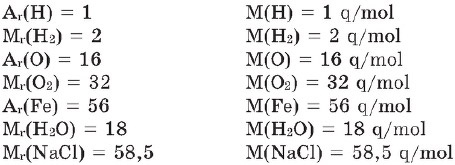
- Müqayisədən göründüyü kimi, maddələrin molyar kütləsi vahidinə görə nisbi atom və ya nisbi molekul kütlələrindən fərqlənir. Yəni molyar kütlə ölçü vahidinə malikdir.
- Yuxarıda yazılanlardan məlum olur ki, molyar kütlə anlayışı həm kimyəvi elementlərə, həm də molekulyar və qeyri-molekulyar quruluşlu bəsit və mürəkkəb maddələrə tətbiq olunur.
- Maddələrin molyar kütləsindən və Avoqadro sabitindən istifadə etməklə istənilən maddənin bir molekulunun və ya bir atomunun kütləsini hesablamaq mümkündür:
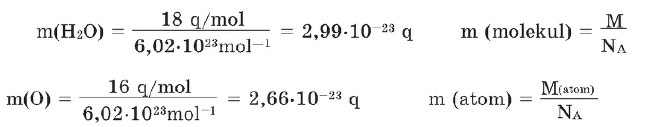
Maddələrin molyar kütləsi ilə onun maddə miqdarı (v) və ixtiyari kütləsi (m) arasında aşağıdakı asılılıq mövcuddur: 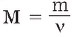
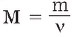
Buradan yazırıq:
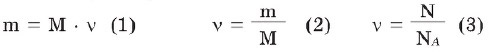
Molyar kütlə anlayışı əsasında hesablamalar
1. Maddə miqdarına görə kütlənin və əksinə, kütləyə görə maddə miqdarının hesablanması:
Məsələ 1. a) 3 mol karbon qazının (CO2); b) 0,2 mol suyun kütləsi nə qədərdir?
m(CO2) = M(CO2) • v (CO2) = 44 q/mol • 3 mol = 132 q
m(H2O) = М(H2О) • v (H2O) = 18 q/mol • 0,2 mol = 3,6 q
Məsələ 2. a) 4 q hidrogen qazı; b) 28 q dəmir neçə moldur?
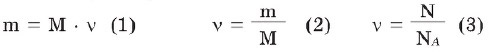
Molyar kütlə anlayışı əsasında hesablamalar
1. Maddə miqdarına görə kütlənin və əksinə, kütləyə görə maddə miqdarının hesablanması:
Məsələ 1. a) 3 mol karbon qazının (CO2); b) 0,2 mol suyun kütləsi nə qədərdir?
m(CO2) = M(CO2) • v (CO2) = 44 q/mol • 3 mol = 132 q
m(H2O) = М(H2О) • v (H2O) = 18 q/mol • 0,2 mol = 3,6 q
Məsələ 2. a) 4 q hidrogen qazı; b) 28 q dəmir neçə moldur?
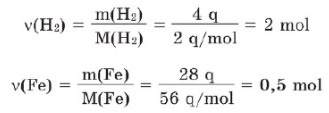
2. Maddənin kütləsi ilə onu təşkil edən hissəciklərin sayı arasındakı əlaqəyə aid hesablamalar:
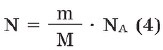
Müəllif: Nasim Abışov,Günay Quliyeva,Vəli Əliyev,Vaqif Abbasov,Mütəllim Abbasov
Mənbə: Ümumtəhsil məktəblərinin 7-ci sinfi üçün Kimya fənni üzrə Dərslik
