Kimyəvi elementlərin nisbi atom kütləsi
Kimyəvi elementlərin nisbi atom kütləsi
Atom-molekul təlimində deyilir ki, bir atom növü başqa atom növündən öz kütləsinə görə də fərqlənir. Artıq bizə məlumdur ki, atomların kütləsi onların nüvəsindəki proton və neytronların kütlələrinin cəmi ilə müəyyən edilir (yalnız yüngül hidrogen atomunda neytron yoxdur). Hər bir atomun proton və neytronlarının cəmi kütlə ədədi adlandırılır. Bəs atomların kütləsini bizim bildiyimiz vahidlərlə (mq, q, kq) ifadə etmək olarmı?
Atomlar o dərəcədə kiçik kütləli hissəciklərdir ki, onların kütləsini birbaşa ən dəqiq (yüz mində bir, milyonda bir dəqiqliklə çəkən) tərəzilərdə belə təyin etmək mümkün deyil. Yalnız fiziki təcrübələrin və riyazi hesablamaların köməyi ilə atomların kütləsini müəyyənləşdirmək olar. Məsələn, hesablanmışdır ki, ən yüngül hidrogen atomunun (protiumun) kütləsi ≈ 1,67•10-24q-dır. Hidrogen atomunun kütləsinə əsasən o biri atomların kütləsini də hesablamaq mümkündür. Təcrübə ilə müəyyən etmək olar ki, eyni həcmdə oksigen hidrogendən 16, azot isə 14 dəfə ağırdır. Onda:
ma(O) = 1,67•10-24 q • 16 =26,7•10-24 qma(N) = 1,67•10-24 q • 14 =23,38•10-24 q
Eyni qaydada hesablanmışdır ki, karbon atomunun kütləsi
ma© = 1,67•10-24 q • 12 =20,00-24 q-dır.
Alınmış çox kiçik ədədlərdən praktik hesablamalarda istifadə etmək əlverişli olmadığından, nisbi atom kütləsi anlayışı qəbul edildi. Bu məqsədlə ilk dəfə C.Dalton atomların kütləsini hidrogen atomunun kütləsi ilə müqayisə etməyi təklif etmişdir. Sonralar müəyyən edildi ki, metalların nisbi atom kütləsini hidrogenə əsasən təyin etdikdə çətinliklər meydana çıxır. Bundan sonra atomların nisbi atom kütləsini oksigenin atom kütləsinin 1/16-nə görə hesabladılar. İzotopların kəşf edilməsi yenə də çətinlik yaratdı. Hazırda nisbi atom kütlələrini təyin etmək üçün ən əlverişli etalon kimi karbon-12 izotopunun (12C) kütləsinin 1/12 hissəsi qəbul edilmişdir. Bu etalona atom kütlə vahidi (a.k.v.) deyilir.
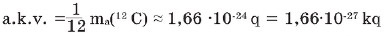
Nəzərə alınmalıdır ki, elementlərin nisbi atom kütləsi hesablandıqda onun yalnız bir atomunun kütləsi deyil, təbiətdə olan izotoplarının orta atom kütləsi götürülərək karbon elementinin 12C izotopunun kütləsinin 1/12-nə bölünür. Elementlərin nisbi atom kütləsi Ar ilə işarə edilir. A— atom sözünün baş hərfidir, r—latınca «relative» — nisbilik mənasını verən sözdür.
Kimyəvi elementlərin nisbi atom kütləsi onun təbii izotoplarının orta atom kütləsinin karbon atomu (12C) kütləsinin 1/12-nə olan nisbətidir.
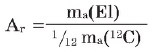
Bu düstura əsasən hidrogen, oksigen, azot və karbonun nisbi atom kütlələri hesablandıqda onların nisbi atom kütlələri müvafiq olaraq belə göstərilir:
Ar(H) = 1,0078 ≈ 1 Ar(N) = 14,0067 ≈ 14
Ar(O) = 15,9994 ≈ 16 Ar© = 12,0110 ≈ 12
Onların oxunuşu belədir: hidrogenin nisbi atom kütləsi təqribən 1-ə; oksigeninki təqribən 16-ya bərabərdir və s.
Proton və neytronların sayı tam ədəd olduğundan istənilən elementin nisbi atom kütləsi tam ədəd olmalı idi. Lakin dövri sistem cədvəlindəki əksər elementlərin nisbi atom kütləsi kəsrlə verilib. Bunun səbəbi elementlərin izotoplarının təbiətdə müxtəlif miqdarda yayılması ilə izah edilir. Elementlərin təbii izotoplarının nisbi atom kütləsi təbiətdə yayılma faizinə vurulur, alınan hasillərin cəmi 100-ə bölündükdə elementin orta nisbi atom kütləsi alınır. Məsələn, xlorun 35Cl izotopunun təbiətdə yayılması 75%, 37Cl izotopunun yayılması isə 25%-dir.
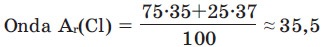
Bütün elementlərin nisbi atom kütlələri «Kimyəvi elementlərin dövri sistemi» cədvəlində verilmişdir.
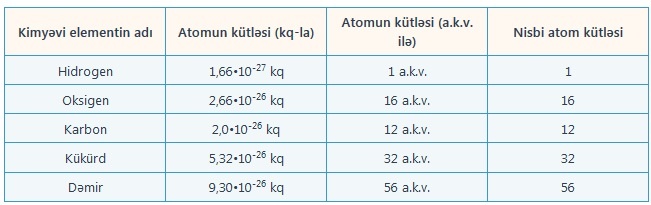
Praktikada, adətən, nisbi atom kütləsindən istifadə edilir. Bunun üçün ölçüsüz kəmiyyət olan nisbi atom kütlələrini və atomun kütlə vahidi ilə ölçülən atom kütləsini (onların sayca uyğun gəlməsinə baxmayaraq) fərqləndirmək lazımdır.
Məsələn:
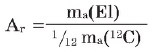
Bu düstura əsasən hidrogen, oksigen, azot və karbonun nisbi atom kütlələri hesablandıqda onların nisbi atom kütlələri müvafiq olaraq belə göstərilir:
Ar(H) = 1,0078 ≈ 1 Ar(N) = 14,0067 ≈ 14
Ar(O) = 15,9994 ≈ 16 Ar© = 12,0110 ≈ 12
Onların oxunuşu belədir: hidrogenin nisbi atom kütləsi təqribən 1-ə; oksigeninki təqribən 16-ya bərabərdir və s.
Proton və neytronların sayı tam ədəd olduğundan istənilən elementin nisbi atom kütləsi tam ədəd olmalı idi. Lakin dövri sistem cədvəlindəki əksər elementlərin nisbi atom kütləsi kəsrlə verilib. Bunun səbəbi elementlərin izotoplarının təbiətdə müxtəlif miqdarda yayılması ilə izah edilir. Elementlərin təbii izotoplarının nisbi atom kütləsi təbiətdə yayılma faizinə vurulur, alınan hasillərin cəmi 100-ə bölündükdə elementin orta nisbi atom kütləsi alınır. Məsələn, xlorun 35Cl izotopunun təbiətdə yayılması 75%, 37Cl izotopunun yayılması isə 25%-dir.
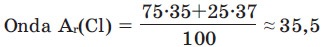
Bütün elementlərin nisbi atom kütlələri «Kimyəvi elementlərin dövri sistemi» cədvəlində verilmişdir.
Praktikada, adətən, nisbi atom kütləsindən istifadə edilir. Bunun üçün ölçüsüz kəmiyyət olan nisbi atom kütlələrini və atomun kütlə vahidi ilə ölçülən atom kütləsini (onların sayca uyğun gəlməsinə baxmayaraq) fərqləndirmək lazımdır.
Məsələn:
Müəllif: Nasim Abışov,Günay Quliyeva,Vəli Əliyev,Vaqif Abbasov,Mütəllim Abbasov
Mənbə: Ümumtəhsil məktəblərinin 7-ci sinfi üçün Kimya fənni üzrə Dərslik
